去壁灵芝孢子粉可增强自身免疫力实验
2018-04-14 13:41:32 发表
文章来源:http://cancer.39.net/kangai/160809/4929669.html
1.材料和方法
1.1 样品:寿仙谷牌去壁灵芝孢子粉,规格:2g/包,批号:20131101,由金华寿仙谷药业有限公司提供,样品形态为粉剂,样品密闭,置常温、干燥、通风处保存。受试样品人体推荐剂量为2.0g/人/日。
1.2 实验动物:选用伤害西普尔-必凯实验动物有限公司繁殖的SPF级CI/F1代健康雌性小鼠200只,体重为18.0-21.9g,实验动物生产许可证号为SCXK(沪)2013-0016,合格证号:2008001643356。
小鼠按随机体重分为I、II、III、IV、V五大个组,每大组40只小鼠,分成4个剂量组,每个剂量组10只。其中I组小鼠进行ConA诱导的小鼠脾淋巴细胞转化、NK细胞活性试验;II组小鼠进行耳廓肿胀试验;III组小鼠进行抗体生成细胞检测和半数溶血值HC50的测定;IV组小鼠进行小鼠碳廓清试验;V组小鼠进行小鼠腹腔巨细胞吞噬鸡红细胞试验。
1.3 剂量选择与受试物给予方式:受试样品的人体推荐剂量为2.0g/人/日(以60kg体重计)设0.17g/kg.bw/d、0.33g/kg.bw/d、1.00g/kg.bw/d三个剂量组(分别相当于受试样品人体推荐量摄入的5倍、10倍、30倍),另设0g/kg.bw/d组以无菌水代替代替受试物。受试样品用无菌水配置,低、中、高剂量配置浓度分别为17mg/mL、33mg/mL、100mg/mL,经口每日一次给予小鼠相应剂量的受试物,小鼠灌胃量为0.1mL/10g.bw。连续灌胃一个月后测定各项增强免疫力功能指标。
1.4 试验方法
1.4.1 ConA诱导小鼠脾淋巴细胞转化试验——MTT法
各剂量组动物连续灌胃一个月后,颈椎脱臼法处死动物,无菌取脾,置于盛有适量无菌Hank’s液的小平皿中,研磨脾脏,制成当个细胞悬液,经200目筛网过滤,用Hank’s液洗2次,每次离心10min(1000r/min),然后将细胞悬浮于1mL RPMI1640完全培养液中,台酚兰染色计数活细胞数(均在95%以上),用 RPMI1640完全培养液调整细胞浓度为3x106个/mL。将细胞悬液分两孔加入24孔培养板中,每孔1mL,一孔加75ULConA液(100ug/ML),另一孔作为对照,置37℃、5%CO2培养箱中培养72h。培养结束前4h,每孔轻轻吸去上清液0.7 mL,加入0.7mL不含小牛血清的RPMI1640培养液,同时加入MTT(5mg/ml)50μl/孔,持续培养4h。培养结束后,每孔加入1ml酸性异丙醇,吹打混匀,使紫色结晶完全溶解。将溶解液移入96孔培养皿中,每孔做三个平行孔,用酶标仪在波长570nm下测定各孔吸光度值。
淋巴细胞增殖能力=加ConA的光密度值-不加ConA的光密度值
用加ConA的光密度值减去不加ConA的光密度值代表淋巴细胞的增殖能力,受试样品组的光密度差值显著高于对照组的光密度差值,可判断该项试验结果阳性。
1.4.2 DNFB诱导小鼠迟发性变态反应(DTH)——耳肿胀法
各剂量组动物连续灌胃一个月后,每鼠用剃毛机将腹部毛剃去,范围为3cm*3cm,用10mg/mL DNFB 溶液50uL均匀涂抹致敏。5日后用10mg/mLDNFB溶液10ul均匀涂抹于小鼠右耳(两面)进行攻击,攻击后24h颈椎脱臼处死小鼠,剪下左右耳壳,用打孔器取下直径8mm耳片,称重。
耳重差(mg)=右耳重(mg)-左耳重(mg)
用左右耳重量之差表示DTH的程度。受试样品组的重量差值显著高于对照组的重量差值,可判断该项试验结果阳性。
1.4.3抗体生成细胞检测——Jerne改良玻片法
各剂量组动物连续灌胃一个月后,每只鼠腹腔注射2%(v/v)的SRBC悬液0.2ml进行免疫,4d后小鼠颈椎脱臼处死,取出脾脏,放在盛有适量无菌Hank's液的小平皿中,研磨牌脏,制成细胞悬液,经200目筛网过旋,离心(1000r/min) 10min,用 Hank's液洗2遍,最后将细胞悬浮于5mL RPMI1640培养液中,计数细胞数,用RPMI1640培养液调整细胞浓度为5x106个/mL。将表层培养基加熱溶解后, 放45℃水浴保温,与等量 pH7.2-7.4两倍浓度的 Hank's液混合,分装小试管, 每管0.5mL,再向管内加10%SRBC(v/v,用SA缓冲液配制)50μL, 20μL脾细胞悬液(5X106个/mL),迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做二个平行片,待琼脂凝固后,将玻片水平扣放在片架上, 放入37℃、5%C02培养箱中孵育1.5h,然后将制备好的补体1:8稀释后加入到玻片架凹槽内,继续孵育1.5h后,计数溶血空斑数。
溶血空斑数=溶血空斑计数x10
用空斑数/106脾细胞来表示, 受试样品组的空斑数显著高于对照组的空斑数,可判定该项试验结果阳性 。
1.4.4血清溶血素测定——半数溶血值(HC50)
各剂量组动物连续灌胃一个月后,制备2% (v/v)的SRBC悬液,每只鼠腹腔注射0.2mL进行免疫,4d后小鼠眼底静脉丛取血于离心管内,放置1h,2000r/min离心10min,分离并收集血清。血清200倍稀释后,按检验方法测定样品管及SRBC半数溶血时的光密度值。溶血素的量以半数溶血值(HC50)表示 。
HC50=样品光密度值/SRBC半数溶血时的光密度值x稀释倍数
溶血素的量以半数溶血值(HC50)表示,受试样品组的HC50显著高于对照组的HC50,可判定该项试验结果阳性。
1.4.5 小鼠碳廓清试验
各剂量组动物连续灌胃一个月后,每鼠尾静脉注入4倍稀释的印度墨汁(0.1mL/10g.bw),待墨汁注入,立即计时。注入墨计后2min及10min分别从眼内毗静脉丛取血20μL, 并将其加到2mL0.1%Na2CO3溶液中,用酶标仪在600nm波长处测光密度值,并取胸腺、肝、脾称重,利用光密度值、肝重和牌重计算吞噬指数a。另计算胸腺/体比、脾/体比。

以吞噬指数a表示小鼠碳廓清的能力。受试样品组的吞噬指数a显著高于对照组的吞噬指数a,可判定该项试验结果阳性。
1.4.6 小鼠腹腔巨噬细胞吞噬鸡红细胞试验——半体内法
各剂量组动物连续灌胃一个月后,制备20% (v/v)的鸡红细胞悬液,每只鼠腹腔注射1mL,问隔30min,颈椎脱臼处死小鼠,将其仰位固定于鼠板上,正中剪开腹壁皮肤,经腹腔注入生理盐水2mL,转动鼠板1min,然后吸出腹腔洗液1mL,平均分滴于2片载玻片上,放入垫有湿纱布的搪瓷盒内,移置37℃恒温培养箱孵育30min,然后,于生理盐水中漂洗,晾干,以1:1丙酮甲醇溶液固定,4%(v/v)Giemsa-磷酸缓冲液染色3min,再用蒸馏水漂洗晾干,封片,光镜下观察。
吞噬百分率(%)=吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数x100
吞噬指数= 被吞噬的鸡红细胞总数/计数的巨噬细胞数
受试样品组的吞噬百分率或吞噬指数与对照组比较,差异均有统计学意义,方可判定该项试验结果阳性。
1.4.7 NK细胞活性测定——乳酸脱氢酶测定法
各剂量组动物连续灌胃一个月后,颈椎脱臼处死小鼠,无菌取脾,置于盛有适量无菌Hank's液的小平皿中,研磨脾脏,制成单细胞悬液,经200目筛网过滤,用Hank's液洗2次,每次离心10min( 1000r/mjn),弃上清将细胞浆弹起,加入 0.5mL灭菌水20秒,裂解红细胞后再加入0.5mL2倍 Hank's液及8mLHank's液,离心10min(1000r/min),用合10%小牛血清RPMI1640完全培养液重悬,1%冰乙酸稀释后计数,台酚兰染色计数活细胞数(均在95%以上),用RPMI1640完全培养液调整细胞浓度为2x107个/mL。
试验前24h将靶细胞(YAC-1细胞)传代培养,应用前以Hank's液洗3次,用RPMI1640完全培养液调整细胞浓度为4x105个/mL。取YAC-1细胞和脾细胞各100μL(效靶比50:1)加入U型96孔培养板中,YAC-1细胞自然释放孔加 YAC-1细胞和培养液各100μL,YAC-1细胞最 大释放孔加YAC-1细胞和2.5%Triton各100μL,上述各项均设三个平行孔,于37℃、5%CO2培养箱中培养4h,然后将96孔培养板以1500r/min离心5min,每孔吸取上清液100μL置平底96孔培养板中,同时加入LDH基质液100μL,反应10min,每孔加入1mo1/L的HCI 30μL,在酶标仪490nm处测定光密度值。
NK 细胞活性( %)=(反应孔OD值-自然释放孔OD值)/ (最 大释放孔OD值一自然释放孔OD值)x100
受试样品组的NK细胞活性显著高于对照组的NK细胞活性,方可判定该项试验结果阳性。
1.5 结果判定:在细胞免疫功能(ConA诱导的小鼠脾淋巴细胞转化,DNFB诱导小鼠 DTH)、体液免疫功能(抗体生成细胞检测,血清溶血素测定)、 单核一巨噬细胞功能(小鼠碳廓清,小鼠腹腔巨噬细胞吞噬鸡红细胞)、NK 细胞活性四个方面任两个方面结果阳性,可判定该受试样品具有增强免疫力功能作用。
其中细胞免疫功能测定项目中的两个试验结果均为阳性,或任一个试验的两个剂量组结果阳性,可判定细胞免疫功能测定结果阳性。体液免疫功能测定结果中两个试验结果均为阳性,或任一个试验的两个剂量组结果阳性,可判定体液免疫功能测定结果阳性。单核-巨噬细胞功能测定项目中的两个试验结果均为阳性,或任一个试验的两个剂量组结果阳性,可判定单核一巨噬细胞功能结果阳性。NK 细胞活性测定试验的一个以上剂量组结果阳性,可判定NK 细胞活性结果阳性。
2 结果
试验过程中动物饮水摄食正常, 外观无异常 。
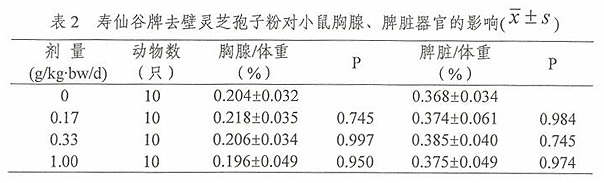
2.1 寿仙谷牌去壁灵芝孢子粉对小鼠胸腺、脾脏器官的影响
经口给予小鼠不同剂量的寿仙谷牌去壁灵芝孢子粉一个月后,取小鼠的胸腺和脾称重,计算脏体比,并对脏体比进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表2结果可见,0.17g/kg.bw/d、0.33g/kg·bw/d、1.00g/kg·bw/d组胸腺体比和脾体比与0g/kg·bw/d组比较,差异无统计学意义(P>0.05)。
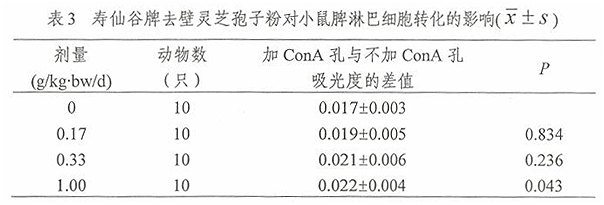
2.2 寿仙谷牌去壁灵芝孢子粉对ConA诱导的小鼠脾淋巴细胞转化的影响
经口给予小鼠不同剂量的寿仙谷牌去壁灵芝孢子粉一个月后,用MTT法进行ConA诱导的小鼠脾淋巴细胞转化实验,计算加ConA孔与不加ConA孔吸光度的差值,并对其进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表3结果可见,1.00g/kg.bw/d组加ConA孔与不加ConA孔吸光度的差值高于0g/kg·bw/d组,差异有统计学意义(p<0.05)。
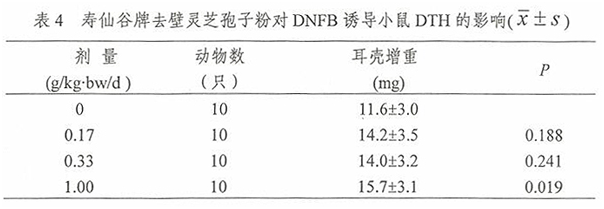
2.3 寿仙谷牌去壁灵芝孢子粉对DNFB诱导小鼠DTH的影响
经口给予小鼠不同剂量的寿仙谷牌去壁灵芝孢子粉一个月后,用耳肿胀法进行DNFB诱导小鼠DTH实验,计算耳売增重,并对其进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表4结果可见,1.00g/kg·bw/d组耳壳增重高于0g/kg·bw/d组,差异有统计学意义(P<0.05)。
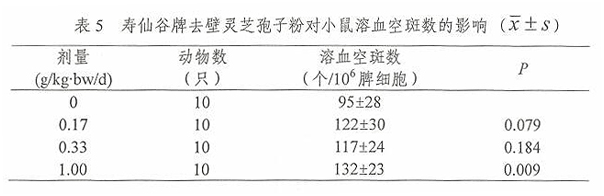
2.4 寿仙谷牌去壁灵芝孢子粉对小鼠抗体生成细胞(溶血空斑数)的影响
经口给予小鼠不同剂量的寿仙谷牌去壁灵芝饱子粉一个月后,用Jernc改良玻片法进行小鼠抗体生成细胞实验,计算溶血空斑数,并对其进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表5结果可见,1.00g/kg·bw/d组小鼠溶血空斑数高于 0g/kg.bw/d组,差异有统计学意义(P<0.05)。
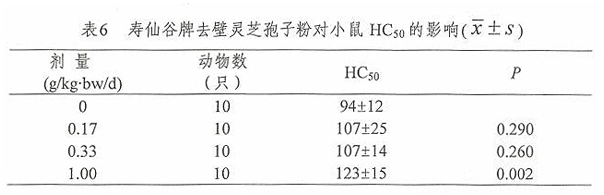
2.5 寿仙谷牌去壁灵芝孢子粉对小鼠血清半数溶血值(HC50)的影响
经口给予小鼠不同剂量的寿仙谷牌去壁灵芝孢子粉一个月后,用半数溶血值法测定小鼠的血清半数溶血值(HC50),并对其进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表6结果可见,1.00g/kg·bw/d组小鼠血清半数溶血值(HC50)高于 0g/kg.bw/d组,差异有统计学意义(P<0.05)。
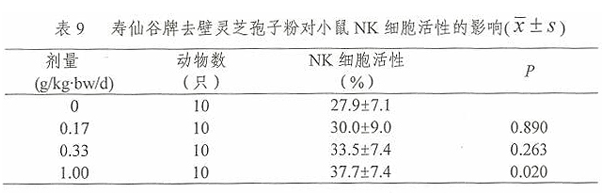
2.6 寿仙谷牌去壁灵芝孢子粉对小鼠 NK细胞活性的影响
经口给予小鼠不同剂量的寿仙谷牌去壁灵芝孢子粉一个月后,用乳酸脱氢酶测定法进行小鼠NK细胞活性测定,将NK 细胞活性经sinP1/2(P为NK细胞活性,用小数表示)转化后进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表9结果可见,1.00g/kg.bw/d组NK细胞活性高于0g/kg·bw/d组,差异有统计学意义(p<0.05)。
3、小结
寿仙谷牌去壁灵芝孢子粉以0.17g/kg·bw/d、0.33g/kg.bw/d、1.00g/kg·bw/d连续给样一个月,结果显示:
3.1 细胞免疫功能: ConA诱导的小鼠脾淋巴细胞转化试验中,1.00g/kg.bw/d组加ConA孔与不加ConA孔吸光度的差值高于0g/kg.bw/d组,差异有统计学意义(P<0.05);DNFB诱导小鼠DTH试验中,1.00g/kg·bw/d组耳売增重高于0g/kg·bw/d组,差异有统计学意义(p<0.05)。此项为阳性。
3.2 体液免疫功能:抗体生成细胞检测试验中,1.00g/kg.bw/d组小鼠溶血空斑数高于0g/kg·bw/d组,差异有统计学意义(p<0.05);小鼠血清半数溶血值试验中,1.00g/kg·bw/d 组小鼠血清半数溶血值(HC50)高于0g/kg·bw/d组,差异有统计学意义(P<0.05)。此项为阳性。
3.3 NK细胞活性:小鼠NK细胞活性测定试验中,1.00g/kg.bw/d组NK细胞活性高于0g/kg·bw/d组,差异有统计学意义(p<0.05)。 此项为阳性。 根据《保健食品检验与评价技术规范》之增强免疫力功能试验的结果判定,在本试验条件下寿仙谷牌去壁灵芝孢子粉具有增强免疫力功能。
